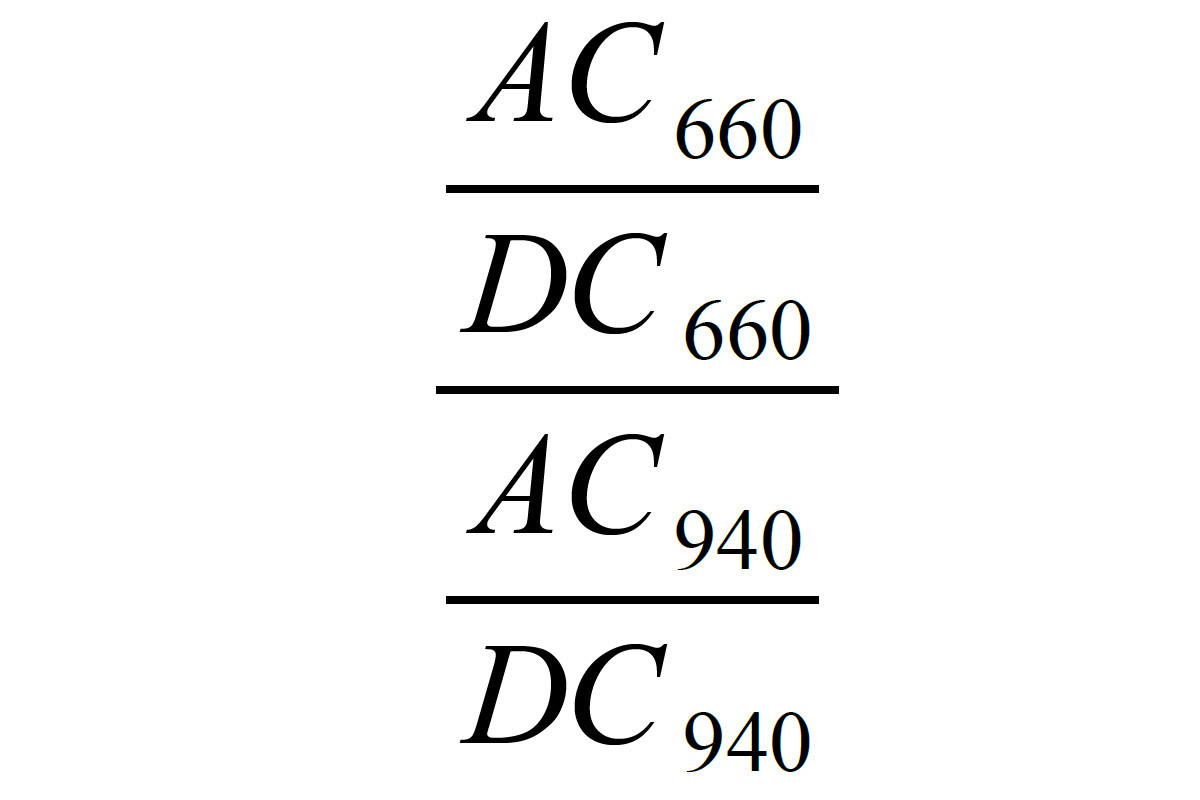Komórki organizmu potrzebują tlenu do oddychania, które jest jednym ze sposobów pozyskiwania przez nie energii. Gaz ten jest transportowany układem krwionośnym. Odtleniona krew jest z serca pompowana do płuc. Tam przepływa przez pęcherzyki, w których następuje wymiana gazowa – uwalniany jest dwutlenek węgla, a krew jest natleniana. Następnie jest ona pompowana z powrotem do serca, a stąd rozprowadzana po całym ciele.
Czerwone krwinki zawierają specjalne białko – hemoglobinę. W wyniku jej reakcji z tlenem powstaje oksyhemoglobina (HbO2). Czerwone krwinki z utlenioną hemoglobiną krążą wraz z krwią po całym organizmie. Kiedy ta wchodzi w kontakt z komórką oksyhemoglobina uwalnia tlen i przekształca się w odtlenioną, zdolną do wiązania tlenu deoksyhemoglobinę (Hb).
Stan zdrowia zależy od tego, jak efektywnie czerwone krwinki rozprowadzają tlen po organizmie. Charakteryzuje to saturacja, czyli stopień nasycenia krwi obwodowej tlenem (SpO2). Poziom SpO2 u zdrowej osoby dorosłej wynosi 95‒100%. Wartość niższa wskazuje na hipoksemię, w której do tkanek nie jest dostarczana wystarczająca ilość tlenu, żeby utrzymać zdrowe narządy i funkcje poznawcze. Skutkiem są zawroty i bóle głowy, dezorientacja, duszność.
Wiele schorzeń powoduje słabe utlenowanie krwi, dlatego wymaga okresowej albo ciągłej kontroli saturacji. Przykłady to: astma, choroby serca i choroby płuc, w tym niedotlenienie wywołane przez Covid-19. Monitorowanie SpO2 jest również kluczowym wskaźnikiem w diagnozowaniu bezdechu sennego.
Dawniej pomiar saturacji wymagał pobrania krwi. Próbkę analizowano w laboratorium. Było to badanie inwazyjne i czasochłonne, którego nie można było przeprowadzać często ani tym bardziej w sposób ciągły. Zmieniło się to wraz z rozwojem pulsoksymetrii. Jest to technika nieinwazyjna. Pulsoksymetry zakłada się na palec, ucho lub wbudowuje w urządzenia noszone. Wynik pomiaru jest uzyskiwany w czasie rzeczywistym.
Jak działa pulsoksymetr?
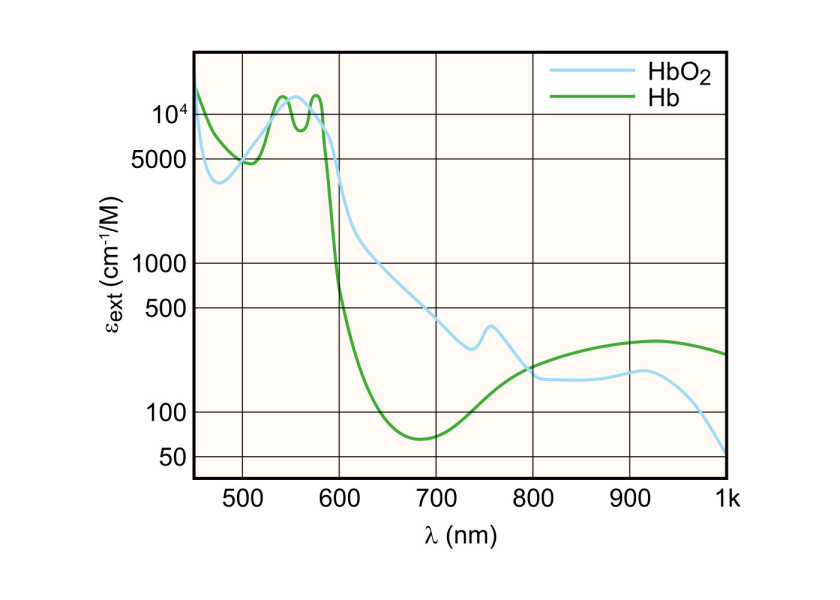
Nasycenie krwi tlenem to stosunek hemoglobiny utlenionej do jej całkowitej ilości. Pulsoksymetria opiera się na tym, że absorpcja światła w oksyhemoglobinie i deoksyhemoglobinie znacząco się różnią w zależności od długości fali. Na rysunku 1 przedstawiono wykres ekstynkcji obu postaci hemoglobiny w świetle widzialnym i w podczerwieni.
Parametr ten jest miarą tego, jak silnie dana substancja chemiczna pochłania światło o określonej długości fali. Jak wynika z rysunku 1 oksyhemoglobina pochłania więcej światła czerwonego (o długości fali 600 nm) i przepuszcza więcej światła podczerwonego (940 nm). Deoksyhemoglobina z kolei pochłania więcej światła w zakresie podczerwieni i przepuszcza więcej światła czerwonego niż hemoglobina utleniona.
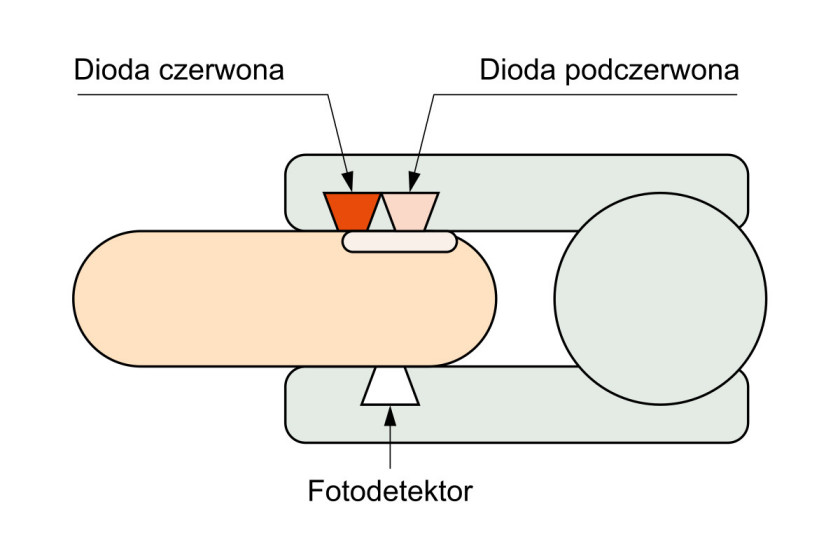
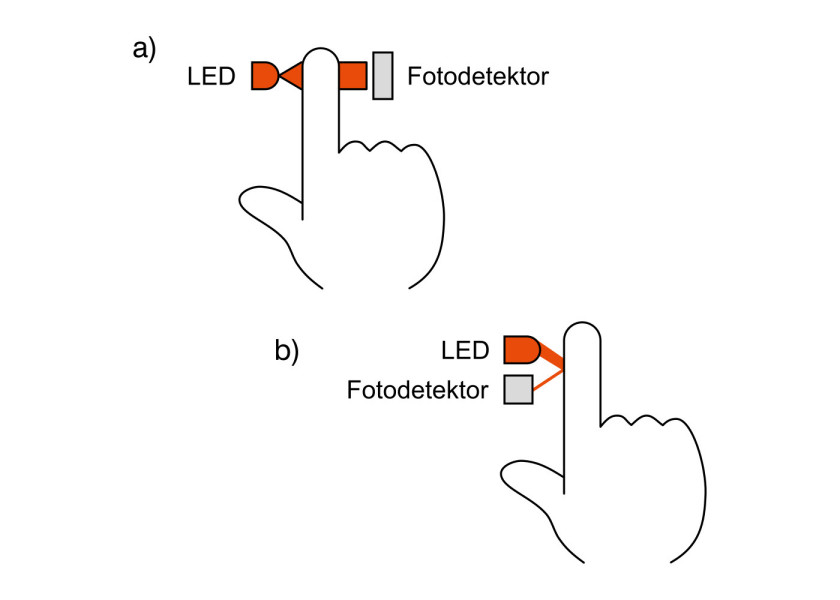
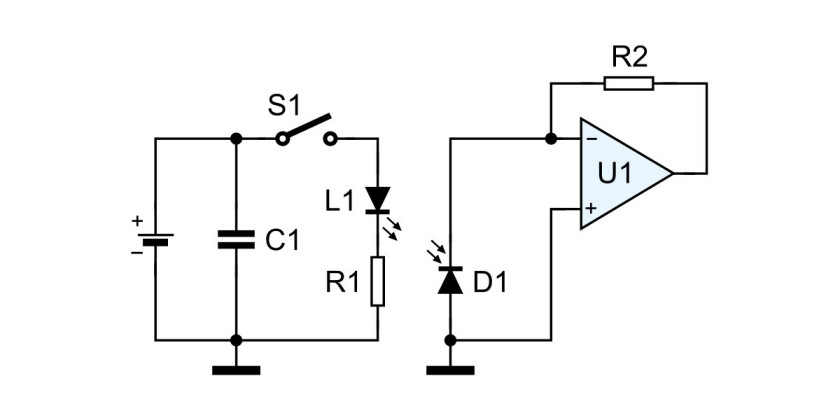
Pulsoksymetr składa się z dwóch diod LED, czerwonej i emitującej promieniowanie podczerwone i fotodetektora (rys. 2), w konfiguracji transmisyjnej albo refleksyjnej (rys. 3). Pomiar saturacji ma następujący przebieg: najpierw włącza się dioda czerwona i rejestrowany jest sygnał fotodetektora. Potem jest to powtarzane dla diody podczerwieni, a na koniec przy obu diodach wyłączonych, by móc skompensować wpływy zewnętrznych źródeł światła na wyniki pomiaru. Sygnały optyczne zatem są przekształcane na prąd (prąd fotopletyzmografii). Następnie są konwertowane do postaci cyfrowej i przetwarzane przez algorytmy zatwierdzone do implementacji w sprzęcie medycznym. Saturacja jest wyznaczana jako względne tłumienie światła o dwóch długościach fal.
Komplikacje
Pomiar saturacji, prosty w teorii, w praktyce się komplikuje. Przede wszystkim przepływ krwi nie jest stały i zmienia się okresowo, naprzemiennie wzrastając i malejąc w rytmie skurczów serca. Wykorzystuje się to jednocześnie z SpO2 mierząc tętno.
Na jakość pomiarów mają oprócz tego wpływ: zakłócenia ścieżek optycznych, ograniczona czułość fotodetektora, światło z otoczenia zmieniające się w zależności od ruchu pacjenta oraz osób, które znajdują się w pobliżu, dryft temperatury parametrów diod i fotodetektora, niedokładna kalibracja, szumy optyczne spowodowane obudową i ruchem obiektu pomiaru względem miernika. Algorytm przetwarzania sygnału musi te wszystkie czynniki dynamicznie kompensować.
Z drugiej strony, ponieważ światło jest mocno rozproszone, diody i fotodetektor nie muszą być ustawione na wprost, ale można je rozmieścić pod kątem, a nawet obok siebie. To ułatwia projektowanie elektroniki noszonej z funkcją pulsoksymetru.
Ważny jest też odpowiedni dobór częstotliwości próbkowania. Większość procesów biologicznych przebiega stosunkowo wolno, dlatego częstotliwość próbkowania jest niska. W przypadku pomiaru saturacji mieści się typowo w zakresie od około 100 próbek/s do kilku tysięcy próbek/s. Z drugiej strony wymagana jest duża rozdzielczość, przynajmniej 16 bitów, a w większości przypadków od 18 do 22 bitów. Przetwornik A/C powinien być też programowany w szerokim zakresie, aby można było dobrać parametry obróbki sygnału w zależności od specyfiki obiektu pomiaru, czyli w tym przypadku rodzaju skóry pacjenta, gęstości tkanek, grubości palców.
Pomiary w praktyce
Na rysunku 4 przedstawiono przykład obwodu pulsoksymetru. Fotodetektor rejestruje światło diod przechodzące przez obiekt pomiaru (palec, płatek ucha). Sygnał na jego wyjściu jest podawany na wejście wzmacniacza operacyjnego w konfiguracji odwracającej.
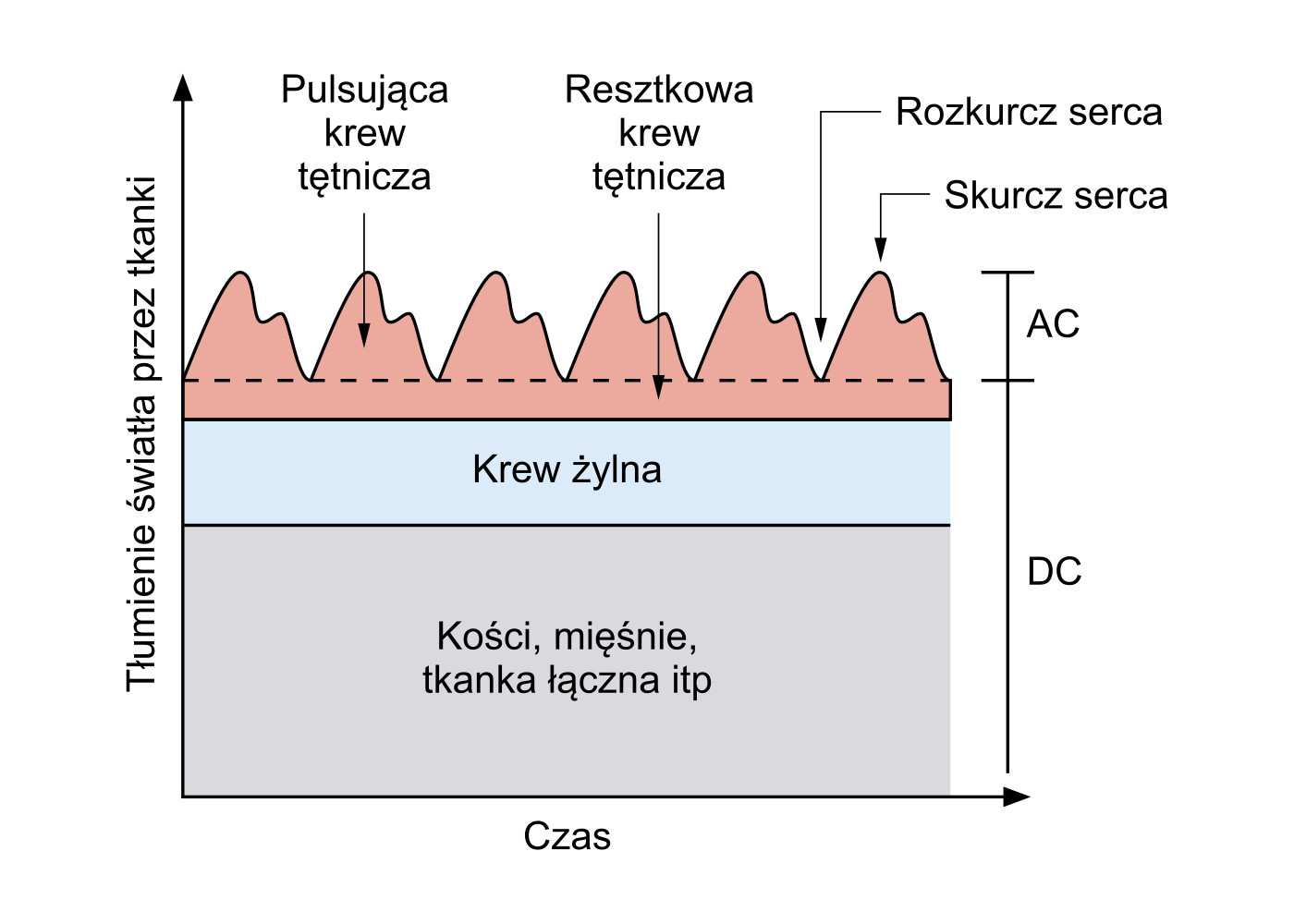
Sygnał na wyjściu pulsoksymetru przedstawiono na rysunku 5. Można w nim wyróżnić składową stałą i składową zmienną. Składowa DC reprezentuje absorpcję światła przez tkankę, krew żylną i niepulsującą krew tętniczą. Składnik AC reprezentuje pochłanianie światła przez pulsującą krew tętniczą.
Składowa zmienna zależy od częstości akcji serca oraz grubości tętnic. Więcej światła odpowiednio odbijanego i przepuszczanego jest w fazie skurczu niż rozkurczu. W skurczu krew pompowana jest z serca, co powoduje wzrost ciśnienia krwi w jego przedsionkach. To skutkuje rozszerzeniem tętnic i prowadzi do zwiększenia objętości krwi przedsionkowej, co powoduje wzrost absorpcji światła. W fazie rozkurczowej ciśnienie krwi spada, podobnie jak absorpcja światła.
Pulsoksymetr analizuje absorpcję światła o dwóch długościach fali i oblicza współczynnik absorpcji uwzględniając składowe DC i AC dla różnych długości fali zgodnie z poniższym wzorem:
Na tej podstawie wartość SpO2 jest odczytywana z tabeli zapisanej w pamięci pulsoksymetru. Na przykład 1 oznacza saturację na poziomie 85%, stosunkowi z formuły 1 równemu 0,4 odpowiada SpO2 100%, a 3,4 – saturacja 0%. Dane odniesienia w tabeli wyznacza się eksperymentalnie mierząc nasycenie krwi tlenem w reprezentatywnej grupie pacjentów.
Decyzje projektowe
Jak pisaliśmy wcześniej, pulsoksymetry realizuje się w konfiguracji transmisyjnej albo refleksyjnej.
W pierwszej z nich mierzone jest niezaabsorbowane światło przechodzące przez daną część ciała. Najlepiej sprawdza się ona w przypadku takich części ciała, jak palec i płatek ucha. Wynika to stad, że występuje w nich gęsta sieć naczyń włosowatych, dzięki czemu pomiary są stabilne, powtarzalne i mniej wrażliwe na przemieszczenia miernika. W konfiguracji transmisyjnej uzyskuje się znaczącą wartość wskaźnika perfuzji, czyli stosunku składowej AC do DC, typowo w przedziale od 40 dB do 60 dB.
Alternatywę, czyli układ refleksyjny preferuje się, jeżeli fotodetektor i diody LED muszą być umieszczone obok siebie ze względów praktycznych, przykładowo w przypadku urządzeń noszonych na nadgarstku lub klatce piersiowej. Te lokalizacje wymagają jednak większego zakresu dynamiki przetwarzania sygnału optycznego ze względu na dużą składową DC. Ta z kolei wynika z rozmieszczenia w tych miejscach tętnic na większej głębokości, poniżej odbijających światło kości, tłuszczu i skóry. Na wskaźnik perfuzji wpływa odległość diod od fotodetektora – przy zbyt małej występuje duże rozproszenie światła, a zatem duża składowa DC. Jego zwiększenie z kolei sprawia, że trzeba użyć diod o większej mocy.
W optycznych pomiarach tętna niektórzy producenci pulsoksymetrów wykorzystują kombinację dużego fotodetektora i wielu zielonych diod, zwłaszcza w miernikach do miejsc o ograniczonym przepływie krwi. Zielone ledy są wybierane ze względu na wysoki stopień tłumienia artefaktów spowodowanych ruchem. Jednakże uzyskuje się to kosztem strat energii – zielone diody LED mają większe napięcie przewodzenia niż czerwone i podczerwone i większą absorbancję w tkankach. Z tych powodów najczęstszą konfiguracją jest pojedynczy układ diod LED zielonej, czerwonej i podczerwieni otoczony wieloma fotodiodami.
Artefakty ruchu stanowią jedno z największych wyzwań w projektowaniu pulsoksymetrów, w ruchu bowiem szerokość tętnic i żył zmienia się pod wpływem ciśnienia, przez co światło jest pochłaniane i odbijane inaczej niż wtedy, gdy ciało jest w spoczynku. Aby ograniczyć ich wpływ, zwiększa się rozmiar fotodetektora, ale możliwości jego powiększania są ograniczone. Dlatego artefakty ruchu trzeba filtrować. W tym przypadku proste techniki filtrowania pasmowo-przepustowego niestety się nie sprawdzą, dlatego stosuje się zaawansowane filtry adaptacyjne.
Umiejscowienie pulsoksymetru powoduje dodatkowe problemy. Przykładowo w tych noszonych na nadgarstku składowa AC stanowi tylko 1%‒2% całkowitego światła odbieranego przez fotodiodę. Aby uzyskać certyfikat klasy medycznej i rozróżnić niewielkie wahania poziomu oksyhemoglobiny, wymagany jest większy zakres dynamiki składowej AC. Można to osiągnąć poprzez zmniejszenie zakłóceń światła otoczenia.
Przykład - MAX30100
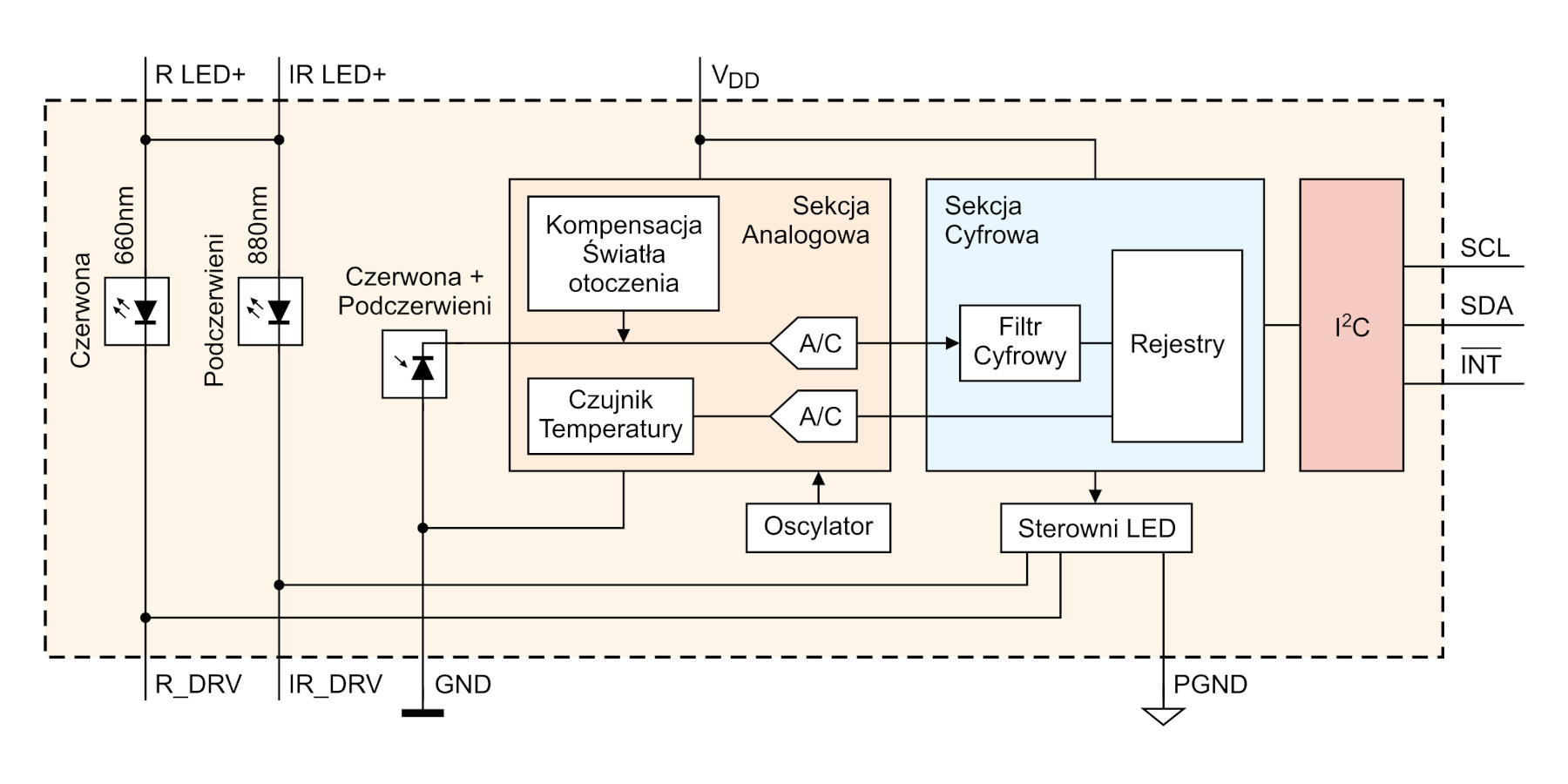
MAX30100 to układ do pomiaru nasycenia krwi tlenem oraz monitorowania tętna. W obudowie zintegrowano: dwie diody LED, fotodetektor, układ optyczny oraz układ przetwarzania sygnału analogowego zoptymalizowany pod kątem redukcji szumów. Główne elementy sekcji pomiaru saturacji to: blok eliminacji wpływu światła otoczenia, 16-bitowy przetwornik A/C sigma, delta z ciągłym nadpróbkowaniem w czasie i filtr cyfrowy, który usuwa zakłócenia 50 Hz/60 Hz oraz resztkowy szum otoczenia o niskiej częstotliwości. Wyjściową szybkość transmisji danych A/C można zaprogramować w zakresie od 50 Hz do 1 kHz.
MAX30100 ma też wbudowany sensor temperatury do opcjonalnej korekcji temperaturowej pomiarów SpO2. Zaimplementowany algorytm wyznaczania saturacji jest stosunkowo niewrażliwy na temperaturową zmianę długość fali światła diody podczerwieni, ale długości fali światła czerwonej diody LED ma kluczowe znaczenie dla prawidłowej interpretacji danych. Dane czujnika temperatury można zatem wykorzystać do kompensacji błędu SpO2 w wyniku zmian temperatury otoczenia.
Prąd diod można zaprogramować w zakresie od 0 do 50 mA, a szerokość impulsu w przedziale od 200 μs do 1,6 ms. To pozwala zoptymalizować dokładność pomiaru i zużycie energii w zależności od specyfiki aplikacji.
Częstotliwość próbkowania przetwornika A/C też można zmieniać w zakresie od 50 próbek/s do 1 tys. próbek/s. Maksymalna częstotliwość próbkowania zależy od wybranej szerokości impulsu, która z kolei determinuje rozdzielczość przetwornika. Na przykład, jeżeli szerokość impulsu jest ustawiona na 200 μs, wówczas rozdzielczość konwersji A/C wynosi 13 bitów i można wybierać spośród wszystkich dostępnych częstotliwości próbkowania od 50 próbek/s do 1 tys. próbek/s. Jeśli jednak wybrano szerokość impulsu 1600 μs, można ustawić tylko częstotliwości próbkowania 100 i 50 próbek/s.
W trybie wyłącznie pomiaru tętna czerwona dioda jest nieaktywna – do wyznaczania pulsu wykorzystywana jest tylko dioda podczerwieni. Pozwala to na oszczędność energii, również dlatego, że można zmniejszyć napięcie zasilanie na zacisku IR_LED+, gdyż napięcie przewodzenia diody IR jest znacznie mniejsze niż czerwonej diody LED.
MAX30100 jest wykorzystywany w elektronice noszonej, monitorach fitness i urządzeniach medycznych. Schemat funkcyjny tego układu przedstawiono na rysunku 6.
Monika Jaworowska